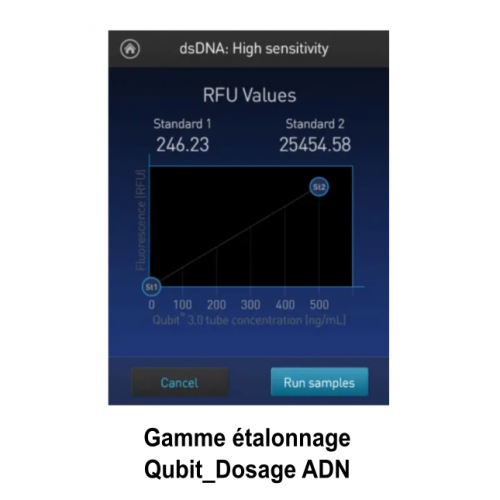
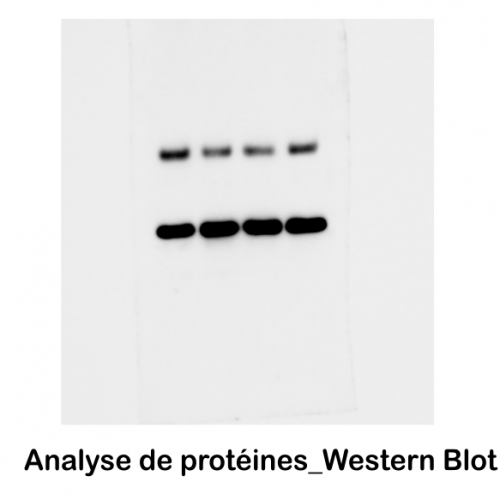
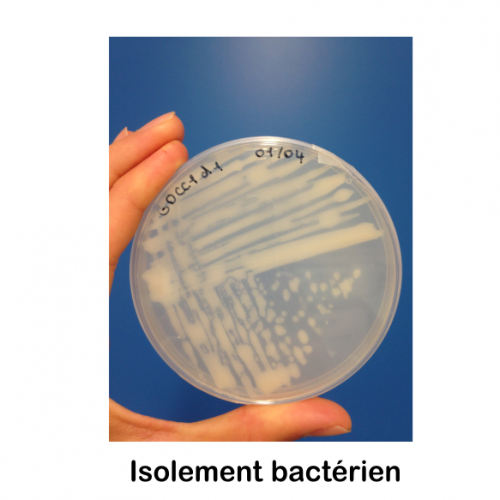
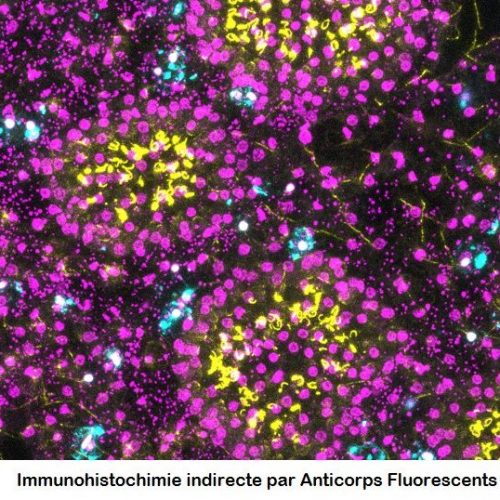
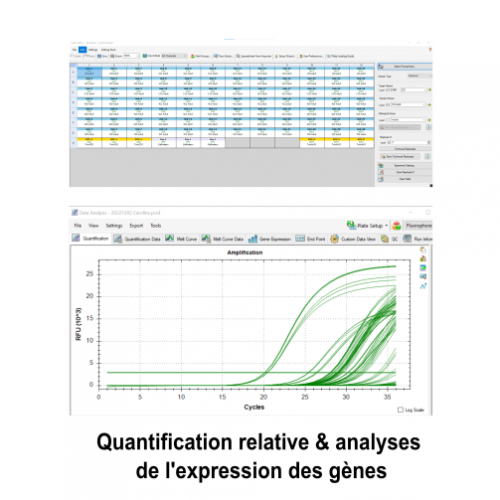
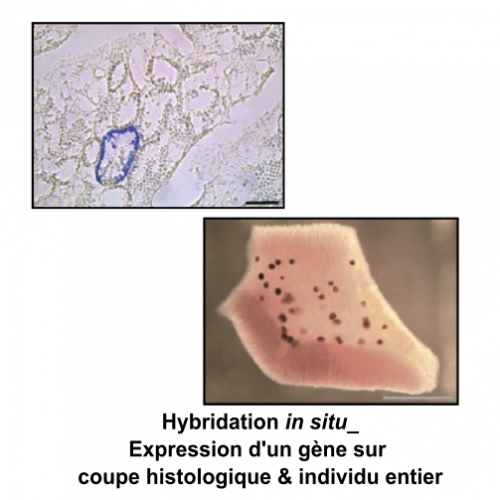
Service Préparation des échantillons pour l’Observation et la production d’images
Présentation
Le Service Préparation des échantillons pour l’Observation et la production d’images (SPOT) est un service dédié à l’imagerie et aux préparations d’échantillons destinées à l’observation et à l’analyse en microscopie.
Le SPOT couvre un large champ d’investigation par la production d’images allant du paysage aux microstructures cellulaires.
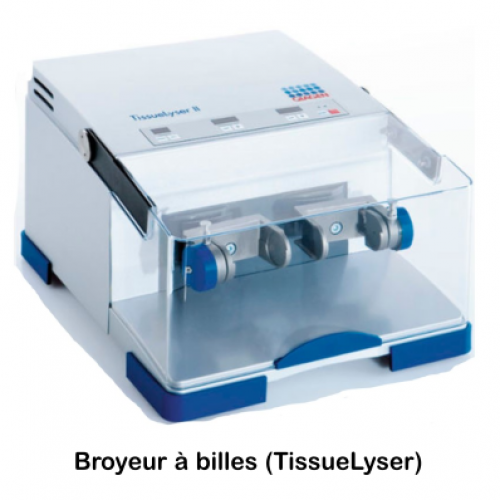
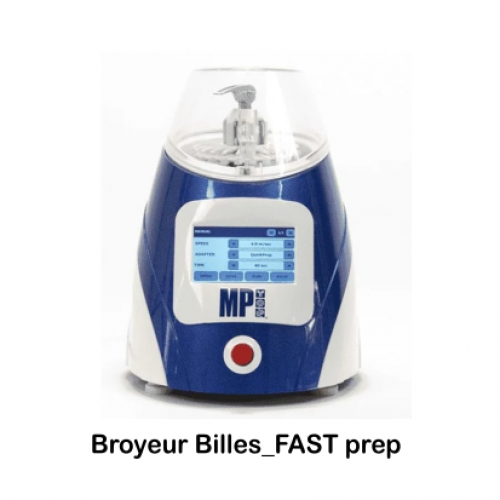
L’équipe maîtrise pour cela l’ensemble des techniques et les adapte en fonction des demandes spécifiques en appui aux projets de recherche de l’IMBE. Ce service dispose des outils de production d’images (drone, binoculaires, microscopes optiques et électroniques) et des techniques de préparation d’objets à observer (photogrammétrie, pétrographie, préparation des pollens, histologie, cytologie).
L’objectif étant d’apporter un appui technique et de conseils aux personnels travaillant sur l’évolution du paysage, cycle de vie, taxonomie, structure morphologique et cellulaire. L’équipe assure également la formation des utilisateurs aux différentes techniques du service.
Le service est réparti sur deux sites : la technopole de l’Arbois et la station marine d’Endoume à Marseille. Il dispose de salle de tri, de préparation et d’observation.