Service Biologie Moléculaire et Cellulaire
Présentation
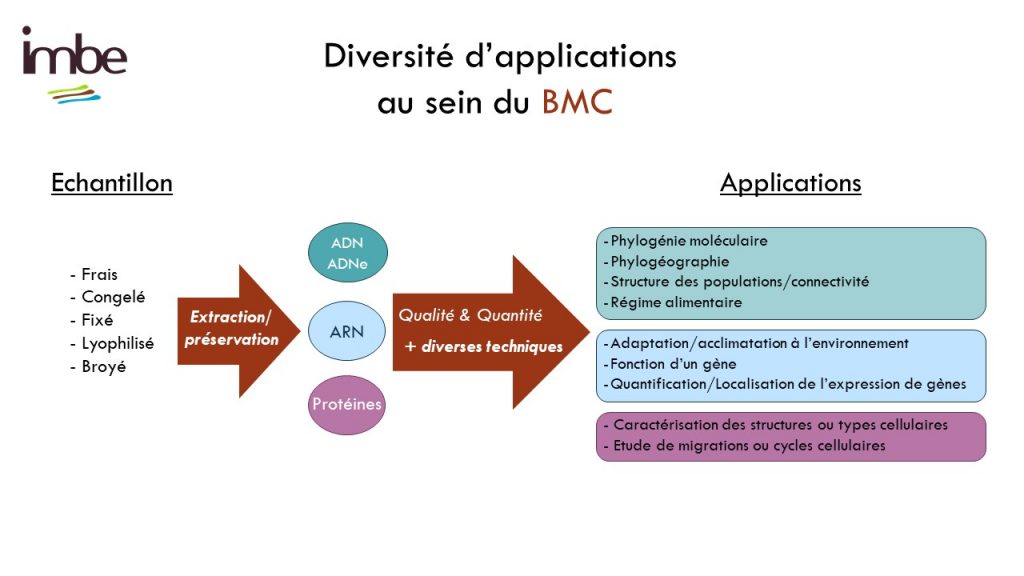
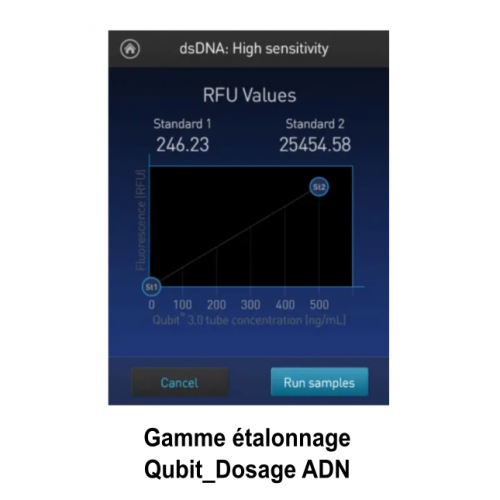
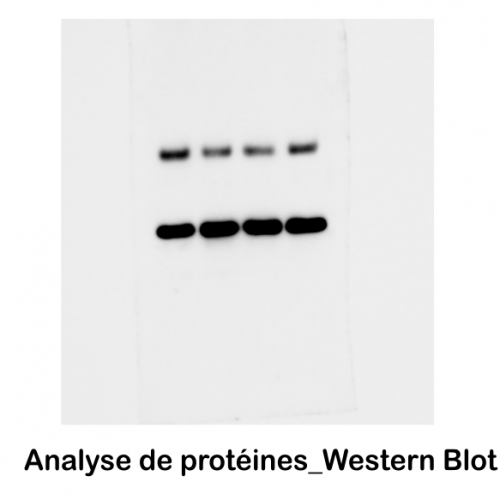
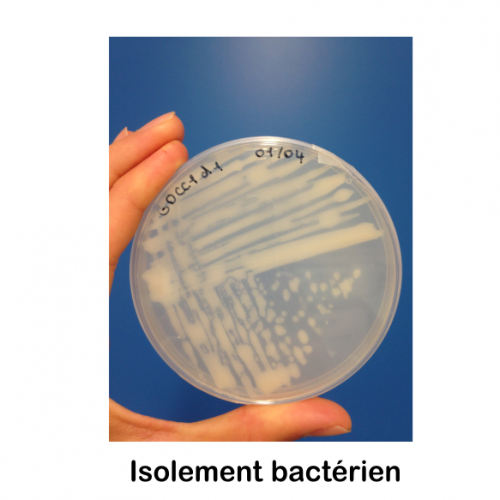
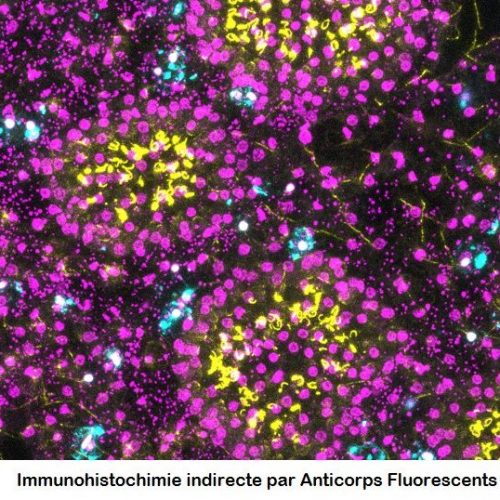
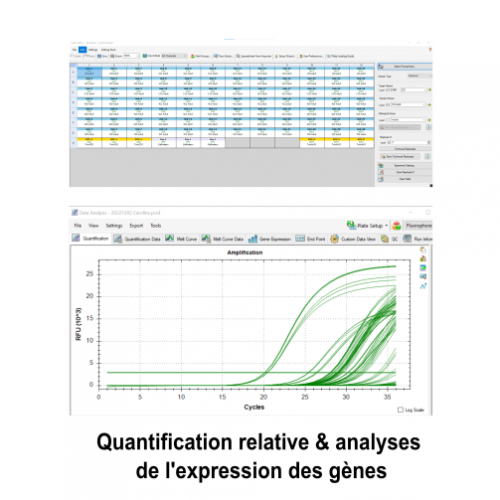
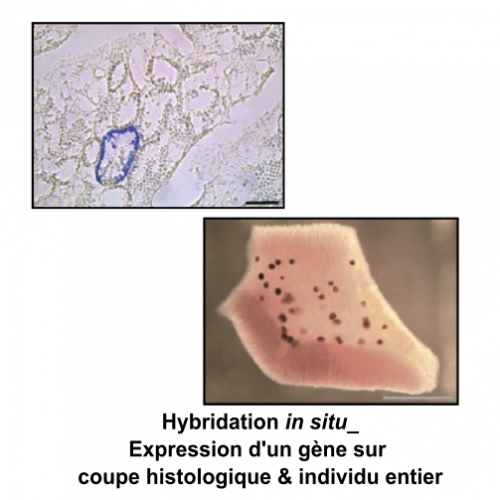
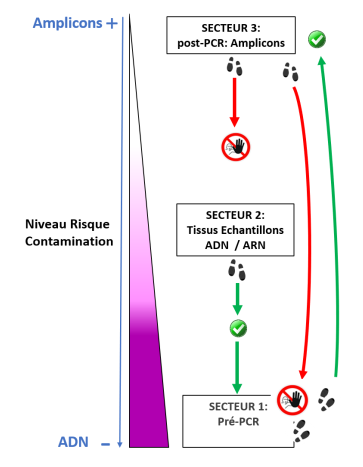
Le service de biologie moléculaire et cellulaire (BMC) est un plateau technique situé à la Station Marine d’Endoume, dédié au développement de projets de recherche axés sur l’étude des macromolécules du vivant (ADN, ARN et protéines). Celui-ci s’étend sur 250m2 de laboratoire d’expérimentations avec 15 salles communes, chacune dédiée à un type d’expérimentation. Afin d’assurer une démarche de qualité, une circulation cohérente « monodirectionnelle » (type marche en avant) est également mise en place pour limiter les risques de contamination des échantillons. Cette configuration est particulièrement avantageuse pour des approches sensibles telles que le metabarcoding.
Le plateau technique du BMC offre des services de supports techniques, de formations et de conseils aux chercheurs et leurs équipes, grâce au soutien de l’équipe du service. En outre, la variété d’équipements et de consommables mutualisés disponibles permet au BMC d’être un levier scientifique pour relever des défis techniques complexes tout en répondant aux besoins de la diversité thématique de l’unité. Cela inclut l’étude de nombreux modèles biologiques non conventionnels, qu’ils soient marins ou terrestres, animaux ou plantes.